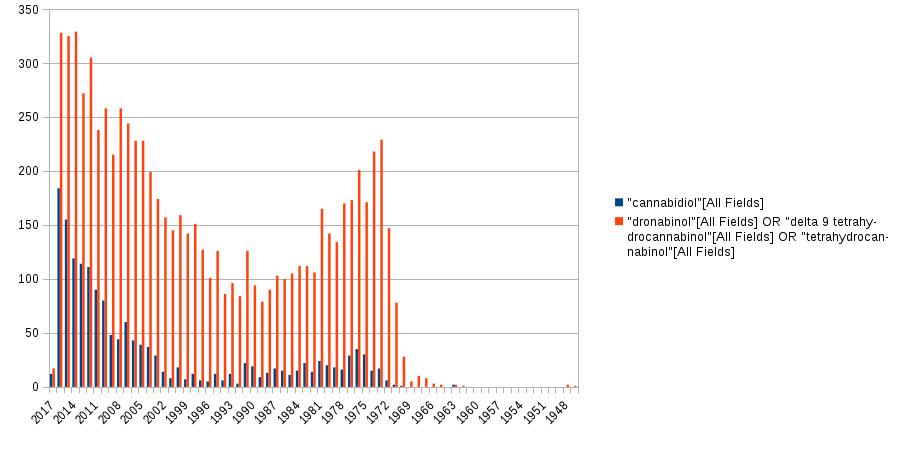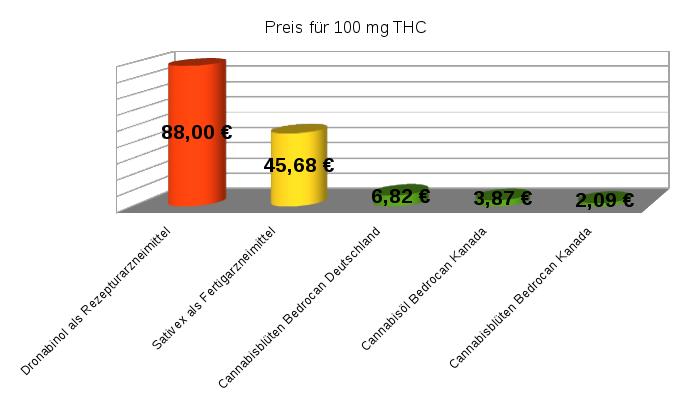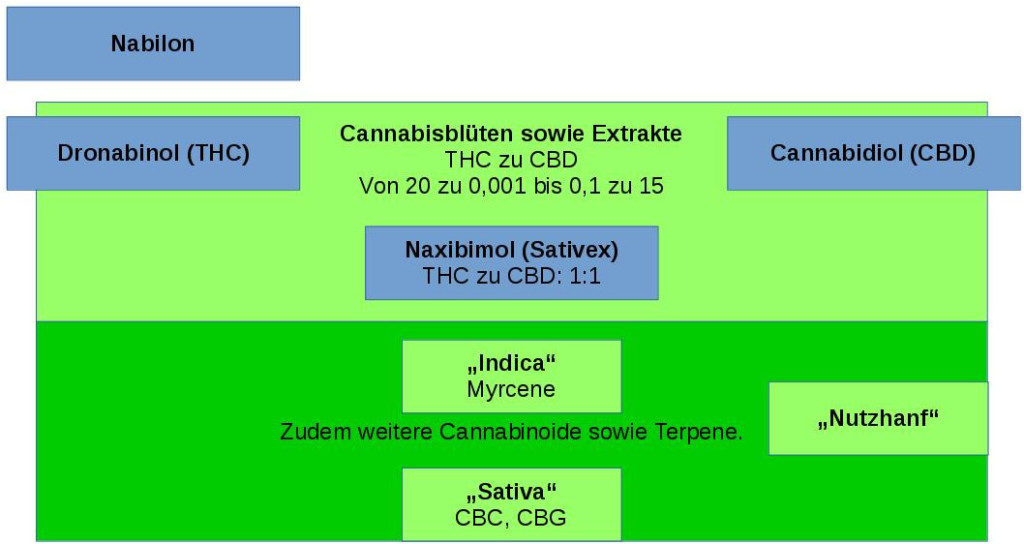
Ein Bild sagt mehr als 1000 Worte und darum habe ich spontan eine Graphik mit einem Überblick über alle heute verfügbaren Cannabis-Medikamente erstellt,
Die Visualisierung soll zeigen dass Cannabisblüten ein Kontinuum an THC zu CBD Verhältnissen bereitstellen, wobei reines THC bzw. CBD zwei Extreme oder Pole darstellen. Sativex liegt als 1 zu 1 Mischung in der Mitte. Das synthetische Nabilon steht außerhalb dieser Ordnung, aber in der Nähe von THC dem es ähnelt.
Nur Blüten haben die zusätzliche Dimension „weitere Cannabinoide und Terpene“. Hier gibt es die drei typischen Ausprägungen Sativa, Indica und „Nutzhanf“. Es gibt noch mehr Dimensionen / Unterschiede gibt als diese drei Typen als „Vektoren“ darstellen können.